Nguyên tố hóa học là gì?
Một nguyên tố là một mục cơ bản không thể dễ dàng chia thành các phần nhỏ hơn. Trong hóa học và vật lý, một nguyên tố là một chất không thể bị phá vỡ bởi các phản ứng phi hạt nhân.
Nguyên tố là cơ sở của hóa học và vật chất. Mỗi phần tử được xác định bởi số proton trong hạt nhân của nó. Các nguyên tố hóa học được tổ chức trong bảng tuần hoàn hóa học. Mỗi phần tử có một số nguyên tử và một ký hiệu. Ký hiệu có thể dựa trên tên Latinh của nó.
Các nguyên tố được phân loại như thế nào?
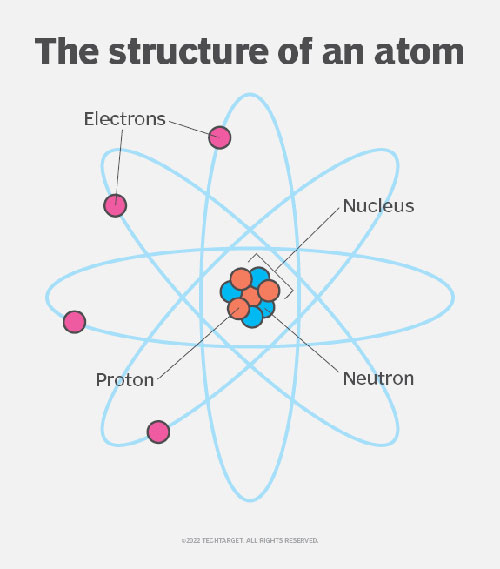
Mỗi nguyên tố được phân loại theo số lượng proton trong hạt nhân của nó, được gọi là số nguyên tử. Số lượng notron trong hạt nhân có thể thay đổi tạo ra các đồng vị. Các đồng vị sẽ có cùng tính chất hóa học, nhưng khác về tính chất vật lý.
Ví dụ, hydro thông thường có một proton và không có notron, deuterium có một proton và một notron, tritium có một proton và hai notron. Tuy nhiên, cả ba đều có thể được phân loại là nguyên tố hydro.
Cùng một nguyên tố cũng có thể khác nhau về số lượng electron mà nó có, tạo ra các ion. Ví dụ, natri (Na) là một nguyên tố có tính phản ứng cao. Na có thể tạo liên kết ion với clo (Cl) trong đó natri mất đi một electron – trở thành Na+ – và nhường nó cho nguyên tử clo – nguyên tử này sau đó trở thành Cl- để tạo thành muối ăn thông thường.
Một số ví dụ về các nguyên tố hóa học là:
- Hydro (H),
- Heli (He),
- Cacbon (C),
- Oxy (O),
- Natri (Na),
- Sắt (Fe),
- Chì (Pb) và
- Vàng (Au)
Bảng tuần hoàn các nguyên tố có 118 nguyên tố khác nhau và 94 trong số này được biết là có trong tự nhiên. 24 nguyên tố khác đã được tổng hợp trong máy gia tốc hạt và không thể ổn định trong thời gian dài; chúng được gọi là các yếu tố nhân tạo.
Các nguyên tố được tạo ra như thế nào?
Phản ứng hóa học không thể thay đổi một nguyên tố. Bản chất và tính chất của một nguyên tố được xác định bởi số lượng proton và notron trong hạt nhân của nó. Lục hạt nhân mạnh giữa các nguyên tử lại với nhau và khó bị phá vỡ. Cấc phản ứng hóa học như đốt cháy hay liên kết không thể làm thay đổi hạt nhân nguyên tử và không thể thay đổi nguyên tố. Một phản ứng hạt nhân (máy gia tốc hạt nhân) là cần thiết để phá vỡ hạt nhân của một nguyên tử.
Để minh họa cho tính chất bất biến của một nguyên tố, hãy tưởng tượng nguyên tử cacbon. Nó liên kết với oxy trong phân tử cacbon dioxide (CO2). Cacbon dioxide được cây cối giữ cho các hoạt động quang hợp. Cacbon được tách ra khỏi CO2 để thêm vào phân tử glucose thành tế bào cây.
Sau khi cây bị đốt cháy nó sẽ thành than, chủ yếu là một khối cacbon nén. Khi than bị nén dưới áp suất lớn, nguyên tử cacbon sẽ được sắp xếp lại thành kim cương.
Toàn bộ quá trình này, cacbon đều phản ứng ở cấu trúc phân tử khác nhau, nhưng nó không thay đổi từ nguyên tố này, sang nguyên tố khác.
Cách duy nhất để thay đổi nguyên tố này thành nguyên tố khác là sử dụng phản ứng hạt nhân. Trong lò phản ứng phân hạch hạt nhân, một nguyên tố nặng có nhiều proton và notron bị tách thành các nguyên tố nhẹ hơn.
Trong các lò phản ứng hạt nhân, nguyên tố uranium bị phân tách do va chạm với các notron tự do và giải phóng năng lượng.
Trong phản ứng tổng hợp hạt nhân, các nguyên tố nhẹ buộc lại với nhau để tạo thành một nguyên tố nhẹ hơn. Phản ứng tổng hợp hạt nhân được xảy ra ở trung tâm của một ngôi sao khi hydro được hợp nhất thành heli.
Khi ngôi sao già đi và lực hấp dẫn của nó tăng lên, nó bị nghiền nát thành các nguyên tố ngày càng nặng hơn.
Lịch sử của các nguyên tố hóa học
Các nhà giả kim đã xác định một số chất như vàng, chì, thủy ngân và lưu huỳnh là không thể thay đổi. 1600 Robert Boyle đã định nghĩa nguyên tố là những đơn chất không thể phân hủy thành các chất cấu thành.
1789 sách “Luận sơ cấp về Hóa Học” ra đời là sách đầu tiên về hóa học. Định nghĩa nguyên tố là một chất không thể chia nhỏ và liệt kê một số nguyên tố đã biết vào thời đó.
1800 John Dalton đã đề xuất thuyết nguyên tử có thể xác định khối lượng nguyên tử của nhiều nguyên tố. 1869 dựa trên khối lượng nguyên tử, Dimitri Mendeleev đã sắp xếp các nguyên tố đã biết theo khối lượng nguyên tử và nhóm chúng theo tính chất tương tự.
Ông cũng dự đoán được các nguyên tố chưa biết dựa trên nghiên cứu của mình. Điều này đã được cải tiến thành cái mà ngày nay chúng ta gọi là bảng tuần hoàn các nguyên tố hóa học.
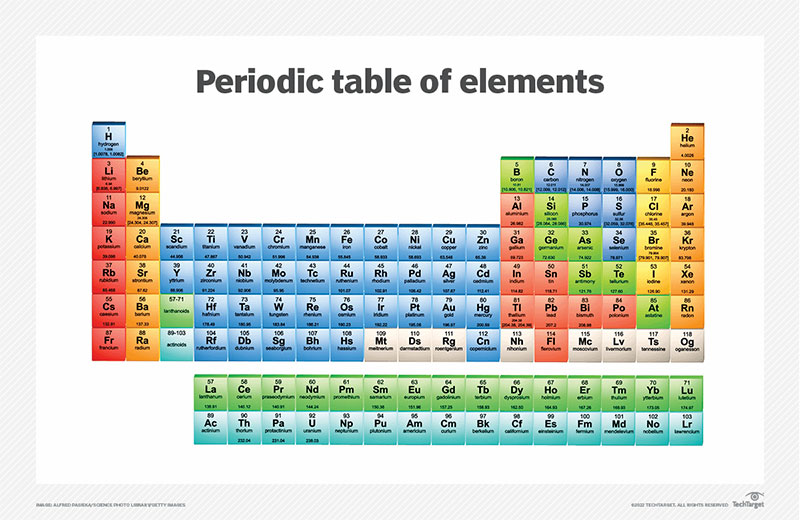
Bảng tuần hoàn các nguyên tố hóa học lớp 8
Bảng nguyên tố hóa học này liệt kê các nguyên tố theo tên theo thứ tự bảng chữ cái bao gồm ký hiệu nguyên tố, số hiệu nguyên tử và giá trị độ âm điện Pauling để tham khảo nhanh chóng và đơn giản.
| Tên nguyên tố | Ký hiệu | Số nguyên tử | Độ âm điện |
|---|---|---|---|
| Actinium | Ac | 89 | 1.1 |
| Aluminum | Al | 13 | 1.61 |
| Americium | Am | 95 | 1.3 |
| Antimony | Sb | 51 | 2.05 |
| Argon | Ar | 18 | |
| Arsenic | As | 33 | 2.18 |
| Astatine | At | 85 | 2.2 |
| Barium | Ba | 56 | 0.89 |
| Berkelium | Bk | 97 | 1.3 |
| Beryllium | Be | 4 | 1.57 |
| Bismuth | Bi | 83 | 2.02 |
| Bohrium | Bh | 107 | |
| Boron | B | 5 | 2.04 |
| Bromine | Br | 35 | 2.96 |
| Cadmium | Cd | 48 | 1.69 |
| Calcium | Ca | 20 | 1 |
| Californium | Cf | 98 | 1.3 |
| Carbon | C | 6 | 2.55 |
| Cerium | Ce | 58 | 1.12 |
| Cesium | Cs | 55 | 0.79 |
| Chlorine | Cl | 17 | 3.16 |
| Chromium | Cr | 24 | 1.66 |
| Cobalt | Co | 27 | 1.88 |
| Copper | Cu | 29 | 1.9 |
| Curium | Cm | 96 | 1.3 |
| Darmstadtium | Ds | 110 | |
| Dubnium | Db | 105 | |
| Dysprosium | Dy | 66 | 1.22 |
| Einsteinium | Es | 99 | 1.3 |
| Erbium | Er | 68 | 1.24 |
| Europium | Eu | 63 | |
| Fermium | Fm | 100 | 1.3 |
| Fluorine | F | 9 | 3.98 |
| Francium | Fr | 87 | 0.7 |
| Gadolinium | Gd | 64 | 1.2 |
| Gallium | Ga | 31 | 1.81 |
| Germanium | Ge | 32 | 2.01 |
| Gold | Au | 79 | 2.54 |
| Hafnium | Hf | 72 | 1.3 |
| Hassium | Hs | 108 | |
| Helium | He | 2 | |
| Holmium | Ho | 67 | 1.23 |
| Hydrogen | H | 1 | 2.2 |
| Indium | In | 49 | 1.78 |
| Iodine | I | 53 | 2.66 |
| Iridium | Ir | 77 | 2.2 |
| Iron | Fe | 26 | 1.83 |
| Krypton | Kr | 36 | 3 |
| Lanthanum | La | 57 | 1.1 |
| Lawrencium | Lr | 103 | |
| Lead | Pb | 82 | 2.33 |
| Lithium | Li | 3 | 0.98 |
| Lutetium | Lu | 71 | 1.27 |
| Magnesium | Mg | 12 | 1.31 |
| Manganese | Mn | 25 | 1.55 |
| Meitnerium | Mt | 109 | |
| Mendelevium | Md | 101 | 1.3 |
| Mercury | Hg | 80 | 2 |
| Molybdenum | Mo | 42 | 2.16 |
| Neodymium | Nd | 60 | 1.14 |
| Neon | Ne | 10 | |
| Neptunium | Np | 93 | 1.36 |
| Nickel | Ni | 28 | 1.91 |
| Niobium | Nb | 41 | 1.6 |
| Nitrogen | N | 7 | 3.04 |
| Nobelium | No | 102 | 1.3 |
| Oganesson | Uuo | 118 | |
| Osmium | Os | 76 | 2.2 |
| Oxygen | O | 8 | 3.44 |
| Palladium | Pd | 46 | 2.2 |
| Phosphorus | P | 15 | 2.19 |
| Platinum | Pt | 78 | 2.28 |
| Plutonium | Pu | 94 | 1.28 |
| Polonium | Po | 84 | 2 |
| Potassium | K | 19 | 0.82 |
| Praseodymium | Pr | 59 | 1.13 |
| Promethium | Pm | 61 | |
| Protactinium | Pa | 91 | 1.5 |
| Radium | Ra | 88 | 0.9 |
| Radon | Rn | 86 | |
| Rhenium | Re | 75 | 1.9 |
| Rhodium | Rh | 45 | 2.28 |
| Roentgenium | Rg | 111 | |
| Rubidium | Rb | 37 | 0.82 |
| Ruthenium | Ru | 44 | 2.2 |
| Rutherfordium | Rf | 104 | |
| Samarium | Sm | 62 | 1.17 |
| Scandium | Sc | 21 | 1.36 |
| Seaborgium | Sg | 106 | |
| Selenium | Se | 34 | 2.55 |
| Silicon | Si | 14 | 1.9 |
| Silver | Ag | 47 | 1.93 |
| Sodium | Na | 11 | 0.93 |
| Strontium | Sr | 38 | 0.95 |
| Sulfur | S | 16 | 2.58 |
| Tantalum | Ta | 73 | 1.5 |
| Technetium | Tc | 43 | 1.9 |
| Tellurium | Te | 52 | 2.1 |
| Terbium | Tb | 65 | |
| Thallium | Tl | 81 | 1.62 |
| Thorium | Th | 90 | 1.3 |
| Thulium | Tm | 69 | 1.25 |
| Tin | Sn | 50 | 1.96 |
| Titanium | Ti | 22 | 1.54 |
| Tungsten | W | 74 | 2.36 |
| Ununbium | Uub | 112 | |
| Ununhexium | Uuh | 116 | |
| Ununpentium | Uup | 115 | |
| Ununquadium | Uuq | 114 | |
| Ununseptium | Uus | 117 | |
| Ununtrium | Uut | 113 | |
| Uranium | U | 92 | 1.38 |
| Vanadium | V | 23 | 1.63 |
| Xenon | Xe | 54 | 2.6 |
| Ytterbium | Yb | 70 | |
| Yttrium | Y | 39 | 1.22 |
| Zinc | Zn | 30 | 1.65 |
| Zirconium | Zr | 40 | 1.33 |
Bài viết liên quan:
